
邢广良,博士,讲师。2019年毕业于南京农业大学食品科学与工程专业,2017-2018年国家公派赴意大利那不勒斯费德里克二世大学Loredana Mariniello教授课题组学术访问。主持完成江苏省高等学校自然科学研究面上项目1项,是International Journal of Biological Macromolecules、Scientific Reports、Foods、Nutrients等学术刊物的特邀审稿人。
邢广良博士长期从事大豆、牛乳致敏蛋白的脱敏研究。迄今为止,以第一作者(共同一作)或通讯作者在Journal of Agricultural and Food Chemistry、LWT-Food Science and Technology、Food Research International等期刊发表论文8篇,引用数556,详见ORCID网站(https://orcid.org/0000-0002-4988-8915)。
近期主要围绕乳酸菌-微生物谷氨酰胺转氨酶(MTG酶)共诱导条件下双蛋白乳的凝胶行为及其脱敏机制展开研究。主要代表性工作如下:
一、MTG酶交联对大豆—牛奶双蛋白乳中蛋白质凝胶行为的影响
通过蛋白质组学方法探索了MTG酶交联结合乳酸菌产酸对大豆—牛奶双蛋白乳中大豆蛋白和牛奶蛋白凝胶行为的影响。二维电泳结果显示,大豆蛋白和牛奶蛋白都是MTG酶良好的作用底物,但大豆蛋白更容易被交联;质谱结果表明,经MTG酶交联后形成的高分子量蛋白聚合物中包含了主要的大豆蛋白和牛奶蛋白亚基。凝胶过程可分为三步(图1):前期大部分大豆蛋白包括7S和11S酸性亚基先被MTG酶交联起来,该时间段是乳酸菌的延滞期,体系内pH值变化不明显;随后,所有7S亚基、11S 酸性亚基以及牛奶蛋白中部分酪蛋白亚基(包括β-酪蛋白和κ-酪蛋白)被MTG酶交联,这期间体系内乳酸菌开始产酸,蛋白质表面的负电荷逐渐被中和;最后,除部分11S碱性亚基及部分酪蛋白、乳清蛋白亚基外,其余绝大多数的大豆蛋白和牛奶蛋白亚基在乳酸菌和MTG酶共同作用下均被交联,双蛋白体系内蛋白表面的负电荷为零并形成致密的网络结构,这为MTG酶催化大豆—牛奶双蛋白体系中交联位点分析、质谱鉴定等提供技术支撑。相关工作发表在Food Research International, 2020, 134, 109200上。
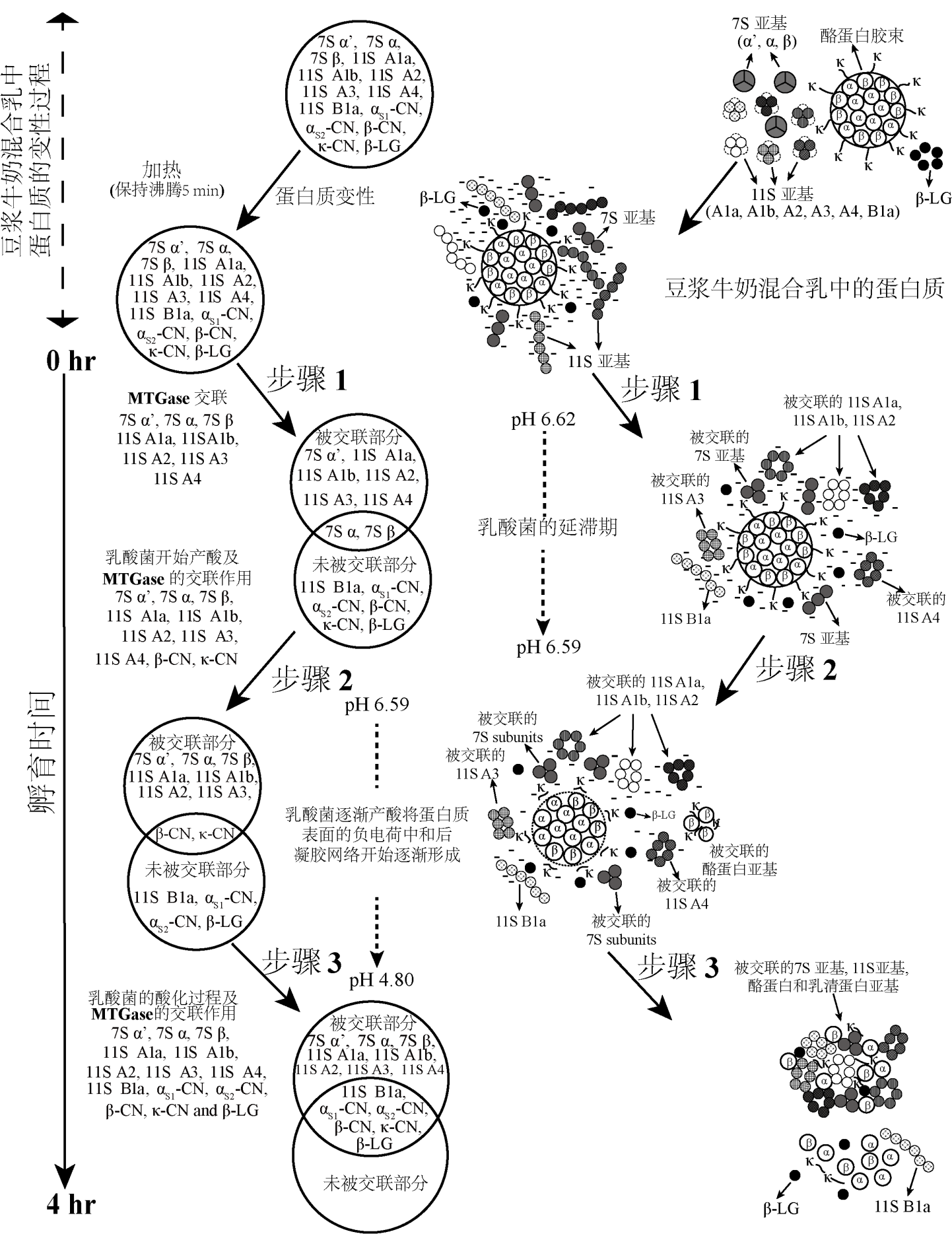
图1 MTG酶交联结合乳酸菌产酸诱导大豆—牛奶双蛋白乳形成凝胶的行为分析
二、酶交联降低大豆—牛奶双蛋白乳中大豆蛋白和β-乳球蛋白的抗原性
通过益生型乳酸菌结合MTG酶作为凝固剂制备大豆—牛奶双蛋白凝胶,结合酶联免疫吸附法(ELISA)对其中大豆蛋白和β-乳球蛋白的抗原性进行研究(图2)。只添加乳酸菌发酵不会显著影响大豆蛋白及β-乳球蛋白的抗原性(P>0.05),但仅在MTG酶的交联作用下,双蛋白乳体系中大豆蛋白抗原性下降至25.7%,显著低于豆浆体系中大豆蛋白67.8%的抗原性(P<0.01);同样,双蛋白乳体系中β-乳球蛋白的抗原性下降至37.1%,显著低于牛奶体系中β-乳球蛋白 63.1%的抗原性(P<0.05)。由此可见,相较于单一的豆浆体系或牛奶体系,双蛋白乳经MTG酶交联后更利于降低其抗原性。因为用于ELISA测试的所有样品中,大豆蛋白及β-乳球蛋白含量均稀释至同一浓度,因此上述结果的差异可能归因于双蛋白乳体系中大豆蛋白—牛奶蛋白交联物的生成及蛋白质结构变化。这为MTG酶交联利于降低双蛋白乳中主要过敏原蛋白的抗原性提供依据。相关结果发表在LWT-Food Science and Technology, 2021, 143, 111178和Journal of Functional Foods, 2019, 53, 292-298。

图2 不同处理对大豆—牛奶双蛋白凝胶中大豆蛋白和β-乳球蛋白抗原性的影响

